enero 31, 2025 Grafeno, Estudios científicos alternativos
Por tanto, es fundamental identificar qué productos lácteos sin lactosa han sido sometidos a estos procesos para detectar la contaminación alimentaria.
Productos lácteos sin lactosa y con óxido de grafeno. ¿Podrían ser la causa de la intolerancia a la lactosa?
Estudio de referencia
Trusek, A.; Dworakowska, D.; Czyzewska, K. (2020). 3D enzymatic preparations with graphene oxide flakes and hydrogel to obtain lactose-free products. Food and Bioproducts Processing, 121, pp. 224-229. https://doi.org/10.1016/j.fbp.2020.03.002
Introducción
La intolerancia a la lactosa es un problema causado por la incapacidad del intestino delgado de producir lactasa, la enzima que permite la transformación de la lactosa en glucosa y galactosa.
Esto puede provocar diarrea, gases, hinchazón y digestiones pesadas tras ingerir productos lácteos.
Los productos lácteos sin lactosa se elaboran generalmente para facilitar la digestión a las personas intolerantes y evitar las afecciones y problemas mencionados.
En este artículo, descubrirá que muchos métodos utilizados para producir alimentos sin lactosa implican el uso de óxido de grafeno.
Hechos analizados
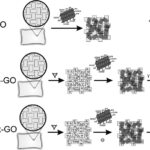
La investigación de (Trusek, A.; Dworakowska, D.; Czyzewska, K., 2020) demuestra que el óxido de grafeno (GO) puede utilizarse como vehículo para la inmovilización de enzimas, lo que permite inhibir la enzima responsable de la generación de lactosa en los procesos de fermentación de productos lácteos.
Para ello,«el artículo desarrolla un método de activación química previo a la inmovilización de moléculas enzimáticas.
Esta propiedad del óxido de grafeno permite inmovilizar la enzima β-galactosidasa tras activar el GO con divinilsulfona».
La β-galactosidasa (o beta galactosidasa) es la enzima que se utiliza para obtener productos sin lactosa.
La β-galactosidasa también es responsable de la fermentación de los azúcares de la lactosa, lo que permite la producción de queso, yogur y otros productos lácteos; en otras palabras, es una enzima que cataliza la hidrólisis de los galactósidos en monosacáridos.
En cuanto a la «divinilsulfona», es un compuesto químico con la estructura molecular «C₄H₆O₂S» que puede derivarse del gas mostaza (Grant, WM; Thomas, CC, 1987), considerado un producto peligroso por sus propiedades tóxicas, corrosivas e irritantes.
La divinilsulfona se ha utilizado para producir hidrogeles porosos (Sannino, A.; Madaghiele, M.; Conversano, F.; Mele, G.; Maffezzoli, A.; Netti, P. A.; Nicolais, L., 2004) y para la producción de fármacos y agentes encapsulantes (Morales-Sanfrutos, J. ; López-Jaramillo, F. J.; Elremaily, M. A.; Hernández-Mateo, F.; Santoyo-González, F. (2015); o la activación de las propiedades de otros compuestos como el quitosano (Pinheiro, B. B.; Ríos, N. S.; Aguado, E. R.; Fernández-Lafuente, R.; Freire, T. M.; Fechine, P. B.; Gonçalves, L. R., 2019).
Los autores afirman que el proceso de separación de lactosa con este método es eficiente y rápido, y permite obtener una baja concentración de lactosa en la corriente efluente a una temperatura muy baja, de 6 °C, que corresponde a las condiciones de almacenamiento de la leche refrigerada.
Para resolver estos problemas, los autores desarrollaron dos enfoques fundamentales : por un lado, la separación enzimática mediante la combinación de copos de GO con divinil sulfona para separar y aislar la enzima β-galactosidasa, y por otro, el desarrollo de un método de producción menos costoso.
Los autores resumen el problema de la siguiente maner a: «El principal inconveniente de los vehículos de grafeno en escamas es la dificultad para separarlos de la solución debido al tamaño y la densidad de las partículas.
Este inconveniente supone un problema tanto durante la preparación del sustrato como durante su aplicación.
En trabajos anteriores, se desarrolló un método de separación de escamas de GO mediante centrifugación ultrarrápida (Trusek, A., 2019).
El método era eficiente, pero caro, sobre todo a gran escala.
Para resolver este problema, se han propuesto preparaciones 3D basadas en la encapsulación de escamas de GO.
El nuevo método combina aplicaciones de hidrogel y GO».
Aunque el método permite eliminar la lactosa a bajo coste, los autores no explican cómo se lleva a cabo este proceso.
De hecho, plantean la hipótesis de que los copos de grafeno se liberan en la solución al combinarse con la lactosa, como se indica en el párrafo siguiente : «La encapsulación del grafeno en los copos de hidrogel facilitó la obtención de los preparados, así como su envasado en la columna del reactor de destilación química.
No hubo resistencia hidráulica durante el paso del sustrato a través de la columna.
Además, las cápsulas de alginato no se rompieron, lo que impidió que los copos de grafeno se liberaran en la solución».
Esto plantea muchas preguntas y cuestiones sin resolver en el artículo, ya que el alimento está en contacto directo con la solución que contiene copos de grafeno.
Entre las conclusiones, cabe destacar que «el procedimiento desarrollado para la preparación de vectores 3D puede utilizarse con cualquier enzima».
Esto significa que el óxido de grafeno, junto con otros componentes, puede utilizarse para inhibir o inmovilizar todo tipo de enzimas.
Esta afirmación la corroboran muchos otros investigadores, como se puede ver en Zhang, J.; Zhang, F.; Yang, H.; Huang, X.; Liu, H.; Zhang, J.; Guo, S. (2010), que consideran el óxido de grafeno como «la matriz para la inmovilización de enzimas», y afirman que «la inmovilización de la enzima en láminas de GO podría tener lugar fácilmente sin el uso de reactivos de reticulación o modificación adicional de la superficie».
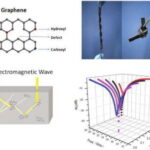
Esto se debe a la capacidad de adsorción del grafeno, que inhibe la enzima, como se muestra en el gráfico de la distribución de la velocidad de reacción de inmovilización de la figura 1.
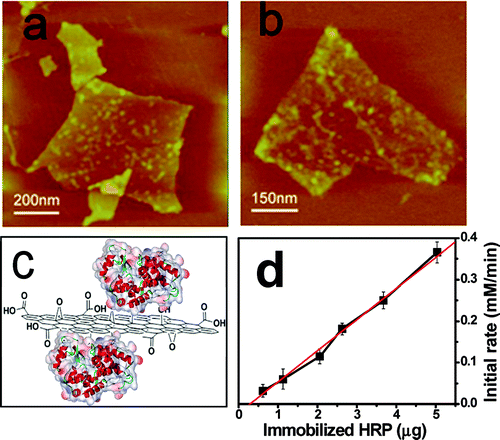
Dado que el óxido de grafeno tiene propiedades especiales para la inmovilización de enzimas, se ha investigado esta técnica para la inmovilización de hidrolasas, una familia de enzimas digestivas que incluye la lactasa y que figura en la clasificación EC3 con el código «3.2.1.108» de la subfamilia de las glucosidasas.
Según Husain (2016), es posible inmovilizar hidrolasas con nanopartículas magnéticas, incluido el óxido de grafeno en combinación con magnetita (Fe₃O₄).
Por lo tanto, es posible que el óxido de grafeno (GO), solo o en combinación con otros componentes en el intestino delgado, pueda inhibir la lactasa, que es la enzima responsable de la digestión de la lactosa y causa intolerancia a esta sustancia.
Este efecto inmovilizador también se confirma en un estudio de Chen, L.; Wei, B.; Zhang, X.; Li, C. (2013), que curiosamente utiliza grafeno y aerogel de Fe₂O₃ (o trióxido de hierro) con una mayor magnetización de saturación (23-54 emu/g^(-1)).
La emu/g (unidad magnética para definir la relación de magnetización por masa) es una unidad de medida utilizada en magnetismo.
Otro estudio similar es el de Jiang et al. (2012), en el que «nanocompuestos magnéticos de óxido de grafeno modificados con nanopartículas de Fe₃O₄ consiguieron inmovilizar tripsina».
La tripsina es una enzima esencial para la digestión, producida en el páncreas y secretada en el duodeno para hidrolizar los péptidos que favorecen la absorción de las proteínas de los alimentos.
Otros estudios
Otros estudios confirman el papel del óxido de grafeno en la elaboración de productos lácteos sin lactosa.
Un ejemplo es el estudio de Morelos-Gómez, A.; Terashima, S.; Yamanaka, A.; Cruz-Silva, R.; Ortiz-Medina, J.; Sánchez-Salas, R.; Endo, M. (2021) que desarrolló membranas de óxido de grafeno para leche sin lactosa.
Las membranas son capaces de filtrar lactosa con una capacidad de permeación de más de 2,5 kg por m^(2) y día.
Los autores afirman que «las simulaciones de dinámica molecular (DM) muestran que la lactosa presenta principalmente interacciones débiles de van der Waals con las capas de GO, lo que permite que la lactosa se difunda a través de los nanocanales de las membranas de GO, mientras que la grasa y las proteínas permanecen en la leche».
Estas propiedades de filtración son similares a las encontradas en la filtración de aguas residuales (Fathizadeh, M.; Xu, W. L.; Zhou, F.; Yoon, Y.; Yu, M., 2017; Wang, J.; Zhang, P.; Liang, B.; Liu, Y., 2017). Xu, T. ; Wang, L. ; Pan, K. 2016), incluido el uranio (Hu, X. ; Wang, Y. ; Yang, J. O. ; Li, Y. ; Wu, P. ; Zhang, H. ; Liu, Z. 2020), así como otros elementos como el plomo (Li, Z. ; Chen, F. ; Yuan, L. ; Liu, Y. ; Zhao, Y. ; Chai, Z. ; Shi, W. 2012).
Sin embargo, al igual que los demás estudios, no se analizan residuos ni trazas de grafeno en la leche y otros productos lácteos, lo que podría causar intoxicación o envenenamiento de los consumidores.
Merece especial atención el trabajo de (De-Brito, A. R.; de-Carvalho-Tavares, I. M.; de-Carvalho, M. S.; de-Oliveira, A. J.; Salay, L. C.; Santos, A. S.; Franco, M., 2020), que estudian la interacción de la «lactasa» en una matriz de nanotubos de carbono CNT, que son nanohojas cilíndricas de grafeno.
Los investigadores demuestran que «la enzima lactasa se absorbe en la zona tubular de los nanotubos de carbono.
El análisis espectroscópico de fluorescencia mostró que la emisión de fluorescencia de la lactasa se debe principalmente al residuo triptófano (TRP) y que esta fluorescencia se reducía en presencia de los CNT, lo que demuestra la interacción entre estos componentes».
Esta afirmación refuerza el argumento de que el óxido de grafeno podría inhibir o inmovilizar muchas de las enzimas digestivas, lo que causaría problemas de intolerancia a la lactosa y otras posibles contraindicaciones aún por descubrir.

Otro ejemplo de inmovilización de enzimas es el descrito por Zhou, L. et al. (2012), en el que la «glucosa oxidasa» se inhibe con óxido de grafeno.
La glucosa oxidasa es la enzima que ayuda a descomponer los azúcares para que puedan ser absorbidos por el organismo.
Obviamente, si se inmoviliza la glucosa oxidasa, podría producirse una disfunción metabólica.
Aunque el estudio estaba orientado al desarrollo de bioelectrodos y biosensores, demuestra que el óxido de grafeno puede interferir en la función metabólica del organismo, como sugerían y afirmaban anteriormente Papi, M., Lauriola, MC, Palmieri, V., Ciasca, G., Maulucci, G. y De-Spirito, M. (2015) y Volkov, Y. y McIntyre, J. ; Prina-Mello, A. 2017; Zhang, Y.; Qin, L.; Sun, J.; Chen, L.; Jia, L.; Zhao, J.; Sang, W. 2020; Jastrzębska, AM, Kurtycz, P. y Olszyna, AR 2012; Singh, Z. 2016 | Jarosz, A.; Skoda, M.; Dudek, I.; Szukiewicz, D. 2016 | Montagner, A.; Bosi, S.; Tenori, E.; Bidussi, M.; Alshatwi, AA; Tretiach, M.; Syrgiannis, Z. 2016).
Reflexiones finales
Se ha demostrado que los productos lácteos sin lactosa podrían ser el resultado de la aplicación de técnicas de filtración con óxido de grafeno para eliminar la lactosa.
Sin embargo, ninguno de los estudios consultados analizaba los posibles residuos de óxido de grafeno en los productos alimenticios ni mencionaba la toxicidad y los efectos negativos que este compuesto puede tener en el organismo humano.
Por tanto, es esencial identificar qué productos lácteos sin lactosa han sido sometidos a estos procesos para detectar la contaminación de los alimentos.
Para ello, es necesario realizar análisis de laboratorio.
Los investigadores también confirman la capacidad del óxido de grafeno, en nanopartículas, solo o en combinación con otros elementos magnéticos como Fe₂O₃ y Fe₃O₄, para inhibir o inmovilizar todo tipo de enzimas presentes en el intestino delgado.
Todavía no se ha analizado la incidencia de las enzimas en otros órganos, pero la literatura científica confirma que su implicación podría ser más amplia, ya que el óxido de grafeno afecta al metabolismo de las células (Jarosz, A.; Skoda, M.; Dudek, I.; Szukiewicz, D., 2016).
Este artículo explica el estrés oxidativo y la alteración de la homeostasis mitocondrial.
Hipótesis
Las personas que han recibido la denominada «vacuna» podrían desarrollar intolerancia a la lactosa y problemas relacionados con la inmovilización de enzimas debido a la capacidad del óxido de grafeno para interferir en su funcionamiento correcto.
También podría darse el caso de que las personas con intolerancia a la lactosa tuvieran concentraciones elevadas de óxido de grafeno o nanopartículas metálicas en el intestino delgado.
Por otra parte, el óxido de grafeno podría interferir en el funcionamiento normal de la tripsina, ya que puede inhibir las enzimas, lo que explicaría los síntomas de indigestión, náuseas, reflujo, dolor abdominal e incluso diarrea.
Bibliografía
1.Chen, L.; Wei, B.; Zhang, X.; Li, C. (2013). Bifunctional graphene/γ‐Fe2O3 hybrid aerogels with double nanocrystalline networks for enzyme immobilization. Piccolo, 9 (13), pp. 2331-2340. https://doi.org/10.1002/smll.201202923
2.De-Brito, AR; de-Carvalho-Tavares, IM; de-Carvalho, MS; de-Oliveira, AJ; Salay, LC; Santos, AS; Franco, M. (2020). Study of the interaction of the lactase enzyme immobilized in a carbon nanotube matrix for the development of the chemically modified carbon paste electrode. Surfaces and interface, 20, 100592. https://doi.org/10.1016/j.surfin.2020.100592
3.Fathizadeh, M.; Xu, WL; Zhou, F.; Yoon, Y.; Yu, M. (2017). Graphene Oxide: A Novel 2-Dimensional Material in Membrane Separation for Water Purification. Advanced Materials Interfaces, 4 (5), 1600918. https://doi.org/10.1002/admi.201600918
4.Grant, WM; Tommaso, CC (1987). Toxicology of the eye. Journal of Toxicology : Cutaneous and Ocular Toxicolog, 6 (2), pp. 155-156. https://doi.org/10.3109/15569528709052171
5.Husayn, Q. (2016). Magnetic nanoparticles as a tool for the immobilization/stabilization of hydrolases and their applications : An overview. Biointerface Research in Applied Chemistry, 6 (6). https://www.researchgate.net/publication/311842151_Magnetic_nanoparticles_as_a_tool_for_the_immobilizationstabilization_of_hydrolases_and_loro_applicazioni_Una_panoramica
6.Hu, X.; Wang, Y.; Yang, JO; Li, Y.; Wu, P.; Zhang, H.; Liu, Z. (2020). Synthesis of graphene oxide nanoribbons/chitosan composite membranes for the removal of uranium from aqueous solutions. Frontiers of Chemical Science and Engineering, 14 (6), pp. 1029-1038. https://doi.org/10.1007/s11705-019-1898-9
7.Jastrzębska, AM, Kurtycz, P. e Olszyna, AR (2012). Recent advances in graphene family materials toxicity investigations . Journal of Nanoparticle Research volume, 14 (12), pp. 1-21. https://doi.org/10.1007/s11051-012-1320-8
8.Jarosz, A.; Skoda, M.; Dudek, io.; Szukiewicz, D. (2016). Oxidative stress and mitochondrial activation as the main mechanisms underlying graphene toxicity against human cancer cells. Oxidative medicine and cellular longevity . https://doi.org/10.1155/2016/5851035
9.Jiang, B.; Yang, K.; Zhao, Q.; Wu, Q.; Liang, Z.; Zhang, L.; Zhang, Y. (2012). Hydrophilic immobilized trypsin reactor with magnetic graphene oxide as support for high efficient proteome digestion. Journal of chromatography A, 1254, pp. 8-13. https://doi.org/10.1016/j.chroma.2012.07.030
10.Li, Z.; Chen, F.; Yuan, L.; Liu, Y.; Zhao, Y.; Chai, Z.; Shi, W. (2012).Uranium (VI) adsorption on graphene oxide nanosheets from aqueous solutions. Chemical engineering journal, 210, pp. 539-546. https://doi.org/10.1016/j.cej.2012.09.030
11.Montagner, A.; Bosi, S.; Tenori, E.; Bidussi, M.; Alshatwi, AA; Tretiach, M.; Syrgiannis, Z. (2016). Ecotoxicological effects of graphene-based materials. 2D Materials, 4 (1), 012001. https://doi.org/10.1088/2053-1583/4/1/012001
12.Morales-Sanfrutos, J.; Lopez-Jaramillo, FJ; Elremaily, MA; Hernández-Mateo, F.; Santoyo-González, F. (2015). Divinyl Sulfone Cross-Linked Cyclodextrin-Based Polymeric Materials : Synthesis and Applications as Sorbents and Encapsulating Agents. Molecules, 20 (3), pp. 3565-3581. https://doi.org/10.3390/molecules20033565
13.Morelos-Gomez, A.; Terashima, S.; Yamanaka, A.; Cruz-Silva, R.; Ortiz-Medina, J.; Sánchez-Salas, R.; Endo, M. (2021). Graphene oxide membranes for lactose-free milk. Carbon, 181, pp. 118-129. https://doi.org/10.1016/j.carbon.2021.05.005
14.Papi, M.; Lauriola, MC; Palmieri, V.; Ciasca, G.; Maulucci, G.; De-Spirito, M. (2015). Plasma protein corona reduces the haemolytic activity of graphene oxide nano and micro flakes. RSC Advances, 5 (99), pp. 81638-81641. https://doi.org/10.1039/C5RA15083C
15.Pinheiro, BB; Rios, NS; Aguado, ER; Fernandez-Lafuente, R.; Freire, TM; Fechine, PB; Goncalves, LR (2019). Chitosan activated with divinyl sulfone : a new heterofunctional support for enzyme immobilization. Application in the immobilization of lipase B from Candida antarctica. International journal of biological macromolecules, 130, pp. 798-809. https://doi.org/10.1016/j.ijbiomac.2019.02.145
16.Sannino, A.; Madaghiele, M.; Conversano, F.; Mele, G.; Maffezzoli, A.; Netti, PA; Nicolais, L. (2004). idCellulose Derivative−Hyaluronic Acid-Based Microporous Hydrogels Cross-Linked through Divinyl Sulfone (DVS) To Modulate Equilibrium Sorption Capacity and Network Stability. Biomacromoléculas, 5 (1), pp. 92-96. https://doi.org/10.1021/bm0341881
17.Singh, Z. (2016). Toxicity of graphene and its nanocomposites to human cell lines-the present scenario. International Journal of Biomedical and Clinical Sciences 1 (1), pp. 24-29. http://files.aiscience.org/journal/article/pdf/70570032.pdf
18.Trusek, A. (2019). Graphene oxide flake activation via divinylsulfone–a procedure for efficient β-galactosidase immobilization. Polish Journal of Chemical Technology, 21 (1). http://dx.doi.org/10.2478/pjct-2019-0006
19.Trusek, A., Dworakowska, D. e Czyzewska, K. (2020).3D enzymatic preparations with graphene oxide flakes and hydrogel to obtain lactose-free products. Food and Bioproducts Processing, 121, pp. 224-229. https://doi.org/10.1016/j.fbp.2020.03.002
20.Volkov, Y.; McIntyre, J.; Prina-Mello, A. (2017). Graphene toxicity as a double-edged sword of risks and exploitable opportunities: a critical analysis of the most recent trends and developments. 2D Materials, 4 (2), 022001. https://doi.org/10.1088/2053-1583/aa5476
21.Wang, J.; Zhang, P.; Liang, B.; Liu, Y.; Xu, T.; Wang, L.; Pan, K. (2016). Graphene Oxide as an Effective Barrier on a Porous Nanofibrous Membrane for Water Treatment. ACS applied materials & interfaces, 8 (9), pp. 6211-6218. https://doi.org/10.1021/acsami.5b12723
22.Zhang, J.; Zhang, F.; Yang, H.; Huang, X.; Liu, H.; Zhang, J.; Guo, S. (2010). Graphene oxide as a matrix for enzyme immobilization. Langmuir, 26 (9), pp. 6083-6085. https://doi.org/10.1021/la904014z
23.Zhang, Y.; Qin, L.; sun, J.; Chen, L.; Jia, L.; Zhao, J.; Sang, W. (2020). Metabolite changes associated with earthworms (Eisenia fetida) graphene exposure revealed by matrix-assisted laser desorption/ionization mass spectrometry imaging. Ecotoxicology and Environmental Safety, 205, 111102. https://doi.org/10.1016/j.ecoenv.2020.111102
24.Zhou, L.; Jiang, Y.; Gao, J.; Zhao, X.; Ma, L..; Zhou, Q. (2012). Oriented immobilization of glucose oxidase on graphene oxide. Biochemical engineering journal, 69, pp. 28-31. https://doi.org/10.1016/j.bej.2012.07.025