octubre 17, 2024 Estudios científicos alternativos
La combinación de resveratrol y N-acetilcisteína es capaz de inhibir el desarrollo de tumores provocados por estrógenos.
El resveratrol y la N-acetilcisteína bloquean la fase inicial de la aparición de tumores en células MCF-10F
Estudio de referencia
M. Zahida, M. Saeeda, C. Beselerb, E.G. Rogana, E.L. Cavalieri (2011). Resveratrol and N-acetylcysteine block the cancer-initiating step in MCF-10F cells. DOI : 10.1016/j.freeradbiomed.2010.10.662
Abreviaturas utilizadas en el estudio
COMT : catecol-O-metiltransferasa
CYP : citocromo P450
E2-3,4-Q : estradiol-3,4-quinona
GSH : glutatión
HPLC-ECD : cromatografía líquida de alta resolución con detección electroquímicaMTT : bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio
NAcCys : N-acetilcisteína
NQO1 y NQO2 : NAD(P) H quinona oxidorreductasa 1 y 24-OCH3E1(E2) : 4-metoxiestrona (estradiol)
4-OHE1(E2) : 4-hidroxiestrona (estradiol)
Resv : resveratrol
-SG : glutatión genético
Introducción
Numerosas pruebas demuestran que los estrógenos-3,4-quinonas catecolares reaccionan con el ADN para formar, principalmente, los aductos purificantes 4-hidroxiestrona (estradiol)-1-N3Ade [4-OHE1(E2)-1-N3Ade] y 4-OHE1(E2)-1-N7Gua.
Los sitiosapurínicos resultantes de estos aductos generan mutaciones críticas que provocan la aparición de cáncer.
El modelo de aparición del cáncer se basa en un desequilibrio en el metabolismo de los estrógenos entre las vías de activación que conducen a aductos estrógeno-ADN y las vías de desactivación que conducen a metabolitos y conjugados de estrógenos.
Este desequilibrio puede mejorarse para minimizar la formación de aductos mediante el uso de antioxidantes, como el resveratrol (Resv) y la N-acetilcisteína (NAcCys).
Para comparar la capacidad de Resv y NAcCys de bloquear la formación de aductos estrógeno-ADN, se utilizó la línea celular epitelial mamaria humana MCF-10F tratada con 4-OHE2.
El Resv y la NAcCys dirigieron el metabolismo de la 4-OHE2 hacia procesos protectores.
NACCys reaccionó con quinonas y redujo las semiquinonas a catecoles.
Este proceso también se produjo con el Resv.
Además, el Resv indujo la enzima protectora quinona reductasa, que reduce las E1(E2)-3,4-quinonas a 4-OHE1(E2).
Resv fue más eficaz que NAcCys para aumentar la cantidad de 4-OCH3E1(E2).
La inhibición de la formación de aductos estrógeno-ADN se produjo a dosis más bajas, pero a dosis más altas Resv fue aproximadamente un 50 % más eficaz que NAcCys.
Sus efectos combinados fueron aditivos.
Por lo tanto, estos dos antioxidantes representan una excelente combinación para proteger a los estrógenos catecólicos de la oxidación a quinonas catecólicas.

Numerosas pruebas procedentes de experimentos sobre el metabolismo de los estrógenos [1-3], la formación de aductos de ADN [4-8], la mutagenicidad [9-13], la transformación celular [14-16] y la carcinogenicidad [17-20] sugieren que determinados metabolitos de los estrógenos, en particular los estrógenos catecol 3,4-quinona, reaccionan con el ADN para formar, predominantemente, los aductos purificadores 4-hidroxiestrona (estradiol)-1-N3Ade [4-OHE1(E2)-1-N3Ade]1 y 4-OHE1(E2)-1-N7Gua [4-6] (fig. 1).
4-quinona reaccionan con el ADN para formar, predominantemente, los aductos purificadores 4-hidroxiestrona (estradiol)-1-N3Ade [4-OHE1(E2)-1-N3Ade]1 y 4-OHE1(E2)-1-N7Gua [4-6] (fig. 1). 1).
Los sitios apurínicos resultantes de la formación de estos aductos pueden estar sujetos a un proceso de reparación propenso a errores que puede generar mutaciones críticas capaces de iniciar la formación de tumores [9-11,21].
Este paradigma de iniciación tumoral se basa en la alteración del equilibrio homeostático del metabolismo relacionado con los estrógenos.
Se trata de un equilibrio entre las vías de activación que pueden dar lugar a aductos de estrógeno-ADN y las vías de desactivación que dan lugar a metabolitos y conjugados estrogénicos (Fig. 1).
En apoyo de esta hipótesis están los resultados obtenidos en mujeres en las que el nivel de aductos estrógeno-ADN en la orina de personas sanas es bajo y el de conjugados estrogénicos es alto.
Por el contrario, en la orina de mujeres con cáncer de mama o con alto riesgo de contraer esta enfermedad se encuentran niveles más altos de aductos y más bajos de conjugados [7, 22].
La oxidación de los estrógenos catecol a quinonas puede limitarse mediante la intervención de enzimas de fase II.
Por ejemplo, la catecol-O-metiltransferasa (COMT) cataliza la metilación de los estrógenos catecol, lo que impide su conversión a estrógenos semikinona y quinona (fig. 1).
De hecho, se observó un aumento en la formación de aductos estrógeno-ADN cuando se inhibió la actividad de la COMT [23,24].
El antioxidante celular glutatión (GSH) proporciona una segunda conjugación que impide la reacción de las quinonas de catecol estrogénicas con el ADN, ya sea de forma no enzimática o, de forma más eficaz, mediante la acción catalítica de la glutatión S-transferasa.
Otras enzimas de fase II, como las quinonas reductasas (NQO1 y NQO2), también participan en la detoxificación de las quinonas mediante su reducción a estrógenos catecólicos [25-27] (fig. 1).
El equilibrio entre las vías de activación y desactivación que conducen a aductos de estrógeno-ADN o a estrógenos conjugados, respectivamente, puede mejorarse aún más para minimizar la formación de aductos y maximizar la formación de conjugados.
El uso de compuestos antioxidantes específicos puede lograr potencialmente un mejor equilibrio de la homeostasis estrogénica.
En un estudio preliminar in vitro, probamos varios antioxidantes, como la cisteína, la N-acetilcisteína (NAcCys), el GSH, la melatonina, el resveratrol (Resv) y el ácido lipoico reducido [28].
Los mejores inhibidores de la formación de aductos estrógeno-ADN fueron la melatonina y el NAcCys.
El NAcCys es un acetilaminotiol.
Su producto hidrolítico, la cisteína, es uno de los tres aminoácidos presentes en el antioxidante intracelular GSH [29].
Las alteraciones de la homeostasis del GSH se han relacionado con la etiología y el curso de varias enfermedades humanas, incluido el cáncer [30].
La NAcCys se ha utilizado como fármaco mucolítico [31] y como antídoto para la intoxicación por paracetamol [32].
El Resv (3,5,4′-trihidroxiestilbeno) es un antioxidante natural que se encuentra en las uvas y en muchas otras plantas [37] y tiene efectos anticancerígenos en varios sistemas in vitro e in vivo [38,39].
Utilizando la línea celular epitelial mamaria humana MCF-10F (negativa para el receptor de estrógenos-α y positiva para el receptor de hidrocarburos de arilo), estudiamos los efectos de Resv [16,40] y NAcCys [41] sobre el metabolismo de los estrógenos y la formación de aductos estrógeno-ADN.
En este estudio, comparamos la capacidad de Resv y NAcCys para bloquear la formación de aductos estrógeno-ADN, utilizando cada compuesto por separado y en mezcla.
Materiales utilizados y metodologías
Productos químicos y reactivos
La 4-OHE2 y todos los estándares se sintetizaron en nuestro laboratorio, como se ha descrito previamente [4,5,42,43].
Todos los demás productos químicos se adquirieron a Sigma (St. Louis, MO, EE.UU.) y se utilizaron sin más purificación.
Cultivo y tratamiento celular
Las células MCF-10F se obtuvieron de la ATCC (Rockville, MD, EE. UU.) y se cultivaron en medio DMEM y F12 de Ham (Mediatech) con 20 ng/ml de factor de crecimiento epidérmico, 0,01 mg/ml de insulina, 500 ng/ml de hidrocortisona, 5 % de suero de caballo y 100 μg/ml de penicilina/estreptomicina.
El medio de cultivo sin estrógenos se preparó en medio DME/F12 sin rojo de fenol con suero sin carbón (HyClone, Logan, UT, EE. UU.).
La viabilidad celular se determinó mediante el ensayo MTT (3-(4,5-dimetiltiazol-2-il)-2,5-bromuro de difeniltetrazolio; Sigma) [44].
Ensayo de citotoxicidad
Las células se cultivaron a una densidad de 3000 células/pocillo en placas de 96 pocillos.
Después de 8 h (día 0), se cosecharon las células de una placa de 96 pocillos mediante el ensayo MTT (véase más adelante), mientras que las otras células se trataron con 4-OHE2 (10 μM) con o sin la presencia de varias dosis de NAcCys (0,6-60 μM) y Resv (0,37-36 μM) solas o combinadas entre sí.
Las células se incubaron durante 24 y 72 horas.
En el ensayo MTT, el medio de cultivo de la placa de 96 pocillos se sustituyó por 100 μl de medio fresco que contenía 25 μl de MTT (5 mg/ml en PBS) y se incubó durante 2 h a 37 °C para permitir la reducción del MTT por las células metabólicamente activas y la formación de un fragmento de formazina púrpura.
A continuación, el fragmento se solubilizó añadiendo un 20 % de SDS en DMF:H2O 1:1, pH 4,7 (100 μl) y se incubó toda la noche a 37 °C.
El color violeta se midió a 570 nm en un espectrofotómetro de microplacas μQuant (Bio-Tek Instruments) y se analizó con el software KCjunior (versión 1.41).
Los valores de absorbancia se convirtieron en porcentaje de células viables en comparación con el valor de absorbancia de la muestra en blanco.
Metabolismo
Las células MCF-10F (0,75×105 células) se cultivaron durante 24 horas en un medio que contenía estrógenos.
Para observar el efecto de los antioxidantes en el metabolismo de los estrógenos, las células se preincubaron durante primera vez durante 48 horas con dosis seleccionadas de Resv o NAcCys, solas o combinadas, se lavaron con PBS y, tras añadir medio fresco, se trataron con 10 μM de 4-OHE2 durante 24 horas con o sin antioxidante.
Para mantener la misma concentración de etanol (0,001 %) en todos los experimentos, se prepararon diferentes soluciones madre de NAcCys (0,6-60 μM) y Resv (0,37-36 μM).
Los medios de cinco matraces T-150 de células MCF-10F tratados con cantidades iguales de solución orgánica se utilizaron como controles.
Una vez retirado el medio de los cinco matraces, cada uno de ellos se incubó a 37 °C con 1 ml de tripsina.
Transcurridos 10 minutos, se utilizaron 10 ml de medio de suero doble para combinar las células de los cinco matraces.
El número de células se estimó con un contador Coulter (Beckman Coulter).
Análisis de aductos estrógeno-ADN
Se recogieron los medios, se suplementaron con ácido ascórbico 2 μM (para evitar la posible descomposición de los compuestos) y se procesaron inmediatamente.
La preparación de las muestras y el análisis por HPLC con detección electroquímica (HPLC-ECD) se realizaron tal y como se explica a continuación.
Preparación de las muestras
Los medios de cultivo de cinco matraces de 50 ml se procesaron haciendo que pasaran a través de cartuchos C8 Certify II (Varian, Harbor City, CA, EE. UU.), que se calibraron haciendo pasar 1 ml de metanol, agua destilada y solución amortiguadora de fosfato de potasio (100 mM, pH 8) en secuencia.
Los medios de cultivo recogidos (50 ml) se llevaron a pH 8,0 y se hicieron pasar por los cartuchos.
Los elementos recogidos se fosfataron, se eluyeron con metanol:acetonitrilo:agua:ácido trifluoroacético (8:1:0,1) y se procesaron como se ha descrito anteriormente [15].
HPLC-ECD
Los análisis de todas las muestras se realizaron en un sistema HPLC equipado con dos módulos dispensadores de disolvente ESA Modelo 580, un automuestreador ESA Modelo 540 y un detector electroquímico CoulArray de 12 canales (ESA, Chelmsford, MA, EE.UU.) utilizando el método descrito previamente [15].
Se realizaron curvas de calibración de tres puntos para cada estándar y se analizaron muestras triplicadas para cada punto de datos.
Para identificar los analitos se utilizaron su tiempo de retención y las relaciones de altura de pico entre el pico dominante y los picos de los dos canales adyacentes.
La cuantificación de los analitos se realizó por comparación con cantidades conocidas de estándares.
El porcentaje de recuperación de cada estándar se utilizó para normalizar los datos.
La información detallada, junto con un cromatograma, se ha publicado anteriormente [41].
Análisis estadístico
Citotoxicidad : se utilizó un análisis multivariante de medidas repetidas para comprobar si la supervivencia celular era significativamente diferente entre las células tratadas con 4-OHE2 y las no tratadas con dosis crecientes de NAcCys a las 24, 48 y 72 horas.
Las variables dependientes fueron las nueve dosis, cada una tratada como una variable independiente.
Como el tamaño de la muestra era pequeño para cada dosis y se evaluaban tanto el grupo de tratamiento como el tiempo, se aplicó el factor de corrección épsilon de Huynh-Feldt a los valores p univariantes, ya que los residuos no se distribuían normalmente dentro de cada grupo de tratamiento [45].
Los resultados multivariantes son válidos a pesar de no cumplirse este supuesto.
Se utilizó la prueba de trazas de Pillai para los estadísticos F y se calcularon los valores p para la significación global entre modelos.
Metabolismo : todos los experimentos se repitieron de forma independiente al menos tres veces.
Los datos se presentan como media ± desviación estándar.
Los conjugados de metoxilo, los conjugados de quinona y los aductos de ADN se trazaron por separado para Resv, NAcCys y Resv más NAcCys en nueve combinaciones de dosis.
Los gráficos de dosis-respuesta individuales de Resv y NAcCys sobre los niveles de conjugados de metoxilo, conjugados de quinona y aductos de ADN mostraron que las curvas de dosis-respuesta no eran sistemáticamente paralelas, lo que indicaba la presencia de relaciones más complejas.
Por lo tanto, comprobamos la independencia y el sinergismo/antagonismo utilizando las ecuaciones de Bliss.
Se utilizó la regresión no lineal para modelar la respuesta a la dosis y se comprobó la independencia o el sinergismo/antagonismo utilizando los modelos de Bliss (46).
Los pares de dosis se agruparon en las cuatro categorías siguientes: (1) sin tratamiento antioxidante; (2) NAcCys > 0 y Resv = 0; (3) NAcCys = 0 y Resv > 0; y (4) NAcCys > 0 y Resv > 0.
La independencia de Bliss asume que dos agentes contribuyen cada uno a un efecto, pero no interfieren con la actividad del otro, una suposición que se aplica basándose en los mecanismos de acción de Resv y NAcCys.
El sinergismo de Bliss se produce si a determinadas dosis el efecto combinado crea una potencia mayor que la suma de los efectos de cada agente por separado.
El antagonismo se produce cuando la combinación de los dos agentes produce un efecto menos potente que cualquiera de los agentes por separado.
El modelo de Bliss es una extensión de un modelo de regresión logística de cuatro parámetros que introduce un parámetro denominado «ν» que, cuando es igual a 1, significa que dos agentes son independientes; los valores entre 0 y 1 representan antagonismo y los valores superiores a 1 significan sinergia.
El parámetro ν se añade a las curvas de dosis-respuesta de los agentes individuales para determinar si el modelo mejora tras tener en cuenta la interacción entre los dos compuestos.
Utilizamos estos tres modelos para examinar la relación de cada agente y la combinación de agentes con respecto a los niveles de conjugado metoxilo, conjugado quinona y aducto de ADN.
Los modelos permiten cuantificar el antagonismo, la aditividad o el sinergismo mediante una prueba de significación estadística para el ajuste del modelo.
Todos los análisis se realizaron en SAS versión 9.2 (SAS Institute, Cary, NC, EE.UU.).
Resultados y análisis
NAcCys y Resv revierten la toxicidad de 4-OHE2 en células MCF-10F
En este estudio, examinamos el efecto citotóxico del 4-OHE2 en las células MCF-10F mediante el ensayo MTT.
Observamos cierta citotoxicidad en las células MCF-10F expuestas a 10 μM de 4-OHE2 durante 72 horas, en comparación con las células control (fig. 2), mostrando estas un 42 % de muerte celular tras 72 horas de incubación.
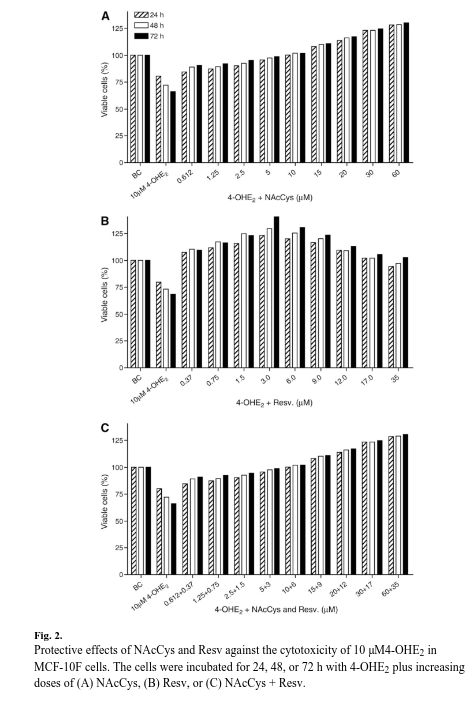
Los gráficos del porcentaje de células viables para examinar los efectos de NAcCys y Resv sobre la citotoxicidad de 4-OHE2 se construyeron convirtiendo los valores de absorbancia de MTT de las células tratadas con dichas sustancias en ratios (porcentaje de células viables) en los días 1, 2 y 3, en comparación con los de los pocillos de control, y se trazaron como un curso temporal.
Tratamos las células MCF-10F con una mezcla de 4-OHE2 (10 μM) más concentraciones crecientes de NAcCys (0,6-60 μM) y/o Resv (0,37-36 μM) y examinamos las células viables durante 0-72 h (fig. 2).
Los resultados indican que la NAcCys puede proteger a las células de los efectos citotóxicos del 4-OHE2 (fig. 2A).
Por ejemplo, la adición de NAcCys aumentó en un 24 % el número de células MCF-10F viables tratadas con 10 μM de 4-OHE2 después de 72 h (del 66 % al 90 %).
Curiosamente, 10 μM de NAcCys abolieron el efecto tóxico de 4-OHE2 a las 24, 48 y 72 horas.
Las dosis más altas de NAcCys (15-60 μM) no solo superaron la toxicidad de la 4-OHE2, sino que también promovieron el crecimiento celular a niveles más altos que los cultivos de control no tratados (por ejemplo, a las 72 h, 110-129 % de células viables, Fig. 2A).
Se observaron diferencias estadísticamente significativas tanto para la dosis como para el tiempo (todas p<0,0001), lo que indica que concentraciones crecientes de NAcCys mejoraron la viabilidad celular en puntos temporales posteriores.
Las incubaciones con Resv mostraron que este compuesto era ligeramente más eficaz que NAcCys. El NAcCys, e incluso la dosis más baja de Resv (0,37 μM), eliminó por completo el daño citotóxico de 10 μM de 4-OcCys en 72 h (fig. 2B).
El efecto protector de Resv frente a 4-OHE2 fue más evidente a medida que aumentaba la dosis.
Se observaron datos similares cuando se combinaron ambos compuestos (NAcCys y Resv) (Fig. 2C).
Así pues, los dos antioxidantes no fueron citotóxicos, sino que, por el contrario, protegieron a las células.
Inhibición de la formación de aductos estrógeno-ADN por Resv y NAcCys
En nuestros experimentos con células MCF-10F, dividimos los productos metabólicos de la 4-OHE2 en tres categorías de compuestos: (1) conjugados de metoxilo [4-OCH3E1(E2)], (2) conjugados de quinona [4-OHE1(E2)-2-SG; 4-OHE1(E2)-2-NAcCys y 4-OHE1(E2)-2-Cys] y (3) aductos purificadores de estrógeno-ADN [4-OHE1(E2)-1-N3Ade y 4-OHE1(E2)-1-N7Gua].
En estudios anteriores, observamos que la formación de conjugados metoxilo y quinona, y de aductos estrógeno-ADN aumenta con dosis más altas de catecoles o quinonas estrogénicas [23,24].
En los experimentos aquí descritos, decidimos utilizar una dosis mínimamente citotóxica de 4-OHE2 (10 μM) con o sin diferentes dosis de antioxidante (Resv o NAcCys) solo o en combinación.
En nuestras condiciones experimentales, observamos que el 4-OHE2 libre era indetectable tras el tratamiento.
Una parte importante se convirtió en el conjugado metoxilo [4-OCH3E1(E2)] por la abundante presencia de COMT en las células [23,24], mientras que los catecoles restantes se oxidaron para formar E1(E2)-3,4-Q.
Las quinonas tienen tres destinos importantes (fig. 1): en primer lugar, pueden ser reducidas por la quinona reductasa (NQO1 o NQO2) [25-27] a catecoles, que pueden ser remetilados por la COMT o reoxidados a quinonas.
En segundo lugar, las quinonas pueden reaccionar con el GSH endógeno para formar un conjugado de GSH.
En tercer lugar, las quinonas pueden reaccionar con el ADN para formar aductos estrógeno-ADN.
El tratamiento de las células con 10 μM de 4-OHE2 solo mostró el resultado esperado (Figs. 3-5), es decir, la formación de metoxi y quinonas, la formación de conjugados metoxi y quinona y la purificación de aductos estrógeno-ADN.
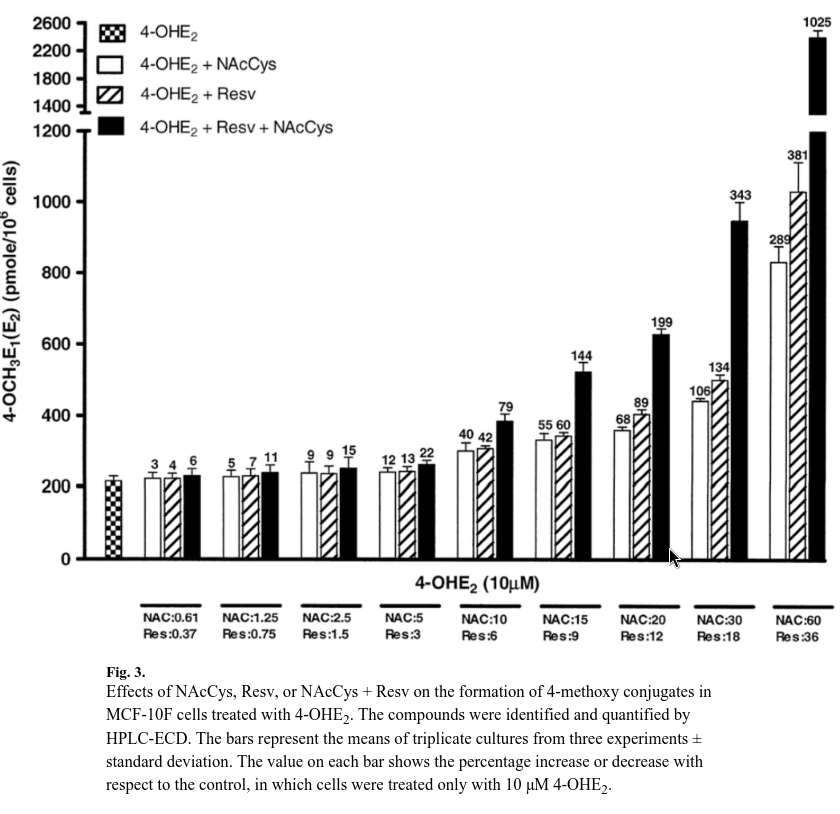
Conjugados metoxílicos
La adición de NAcCys y/o Resv desplazó sustancialmente el metabolismo de los estrógenos hacia vías terapéuticas.
A dosis bajas de NAcCys, este efecto no era evidente, pero cuando NAcCys alcanzó una proporción 1:1 con 4-OHE2, aumentó significativamente el nivel de conjugados metoxilo de 214 ± 25 a 299 ± 40 pmol/millón de células (un 40 % más, Fig. 3).
Se observó un efecto similar con 6 μM de Resv, ya que el nivel de metoxil conjugados aumentó un 42 %, correspondiente a 305 ± 14 pmol/millón de células.
Por otra parte, cuando se añadieron conjuntamente ambos compuestos antioxidantes, el efecto fue mayor y el nivel de metoxil conjugado aumentó un 79 %.
Así pues, el nivel de compuestos metoxílicos aumentó con proporciones más elevadas de antioxidantes, ya fueran solos o mezclados.
En la dosis más alta, en la que NAcCys estaba en una proporción de 1:6 y Resv en una proporción de 1:3,6 con 4-OHE2, los conjugados metoxílicos fueron mayores con Resv, con un aumento del 381 %, mientras que con NAcCys el aumento fue del 298 %.
Con la mezcla, el aumento fue del 1025 %, es decir, tres veces superior al de los compuestos antioxidantes por separado (fig. 3).
Este resultado puede explicarse por las observaciones de experimentos previos en los que NAcCys y Resv redujeron las semiquinonas estrogénicas producidas en estas células durante la oxidación de 4-OHE a catecoles [16,28,47].
La gran cantidad de COMT en las células garantiza que la 4-OHE2 se convierta en 4-OCH3E1(E2) [23,24].
Por lo tanto, Resv fue más eficaz para aumentar la cantidad de 4-OCH3E1(E2) que NAcCys.
Sin embargo, los intentos de modelización no lineal de la curva dosis-respuesta del conjugado metoxilo dieron lugar a resultados no convergentes debido a matrices de Hessiane no singulares.
Por lo tanto, no fue posible realizar pruebas estadísticas de antagonismo, aditividad o sinergia.
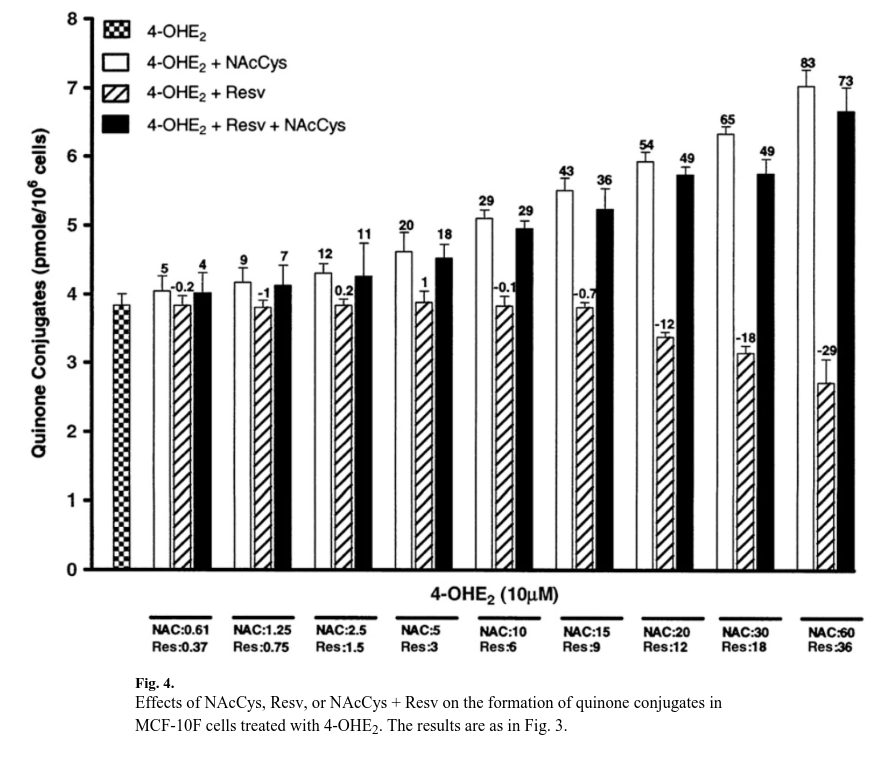
Conjugados de quinona
Se observaron resultados interesantes para los conjugados de quinona, que aumentaron con dosis más altas de NAcCys (fig. 4).
En la dosis más alta, este aumento fue aproximadamente el doble.
Esto se comprende fácilmente si se tiene en cuenta que la NAcCys puede reaccionar directamente con quinonas catecólicas para formar 4-OHE1(E2)-2-NAcCys [43].
Del mismo modo, la NAcCys es un precursor del GSH, que, a su vez, reacciona con E1(E2)-3,4-Q para formar conjugados de GSH.
Estos se convierten, a través de la vía del ácido mercaptúrico, en 4-OHE1(E2)-2-Cys y 4-OHE1(E2)-2-NAcCys (fig. 1).
Por otra parte, el Resv no mostró ningún efecto sobre la formación de conjugados de quinona a dosis bajas, mientras que a las dos dosis más altas (18 y 36 μM), el nivel de conjugados de quinona disminuyó significativamente (Fig. 4).
El efecto de Resv sobre los conjugados de quinona puede explicarse por nuestro hallazgo previo de que Resv no reacciona con E2-3,4-Q para formar ningún compuesto conjugado [28].
Por otro lado, Resv muestra un mayor potencial para reducir la quinona a catecol que el NAcCys y también induce la enzima NQO1, que reduce la quinona a catecol. [16,25,28,40].
Todos estos procesos reducen el nivel de quinonas disponibles para formar conjugados.
En experimentos en los que ambos antioxidantes se utilizaron conjuntamente, el nivel de conjugados se incrementó moderadamente, pero en todas las dosis seleccionadas el nivel refleja la contribución de NAcCys (fig. 4).
De la observación de la Fig. 4 se desprende que Resv y NAcCys tienen efectos opuestos sobre la formación de conjugados de quinona.
La curva dosis-respuesta para los dos agentes era paralela, pero tres de los cuatro parámetros de regresión logística tenían un valor negativo.
Los datos se ajustaron adecuadamente al modelo de Bliss (p<0,0001), pero el parámetro ν fue de 0,82 (intervalo de confianza del 95 %: 0,70-0,97), lo que indica una relación antagónica entre NAcCys y Resv sobre los niveles de conjugados de quinona.
Estos resultados confirman que el principal efecto de la NAcCys sobre los niveles de quinonas conjugadas es que esta reacciona con las quinonas.
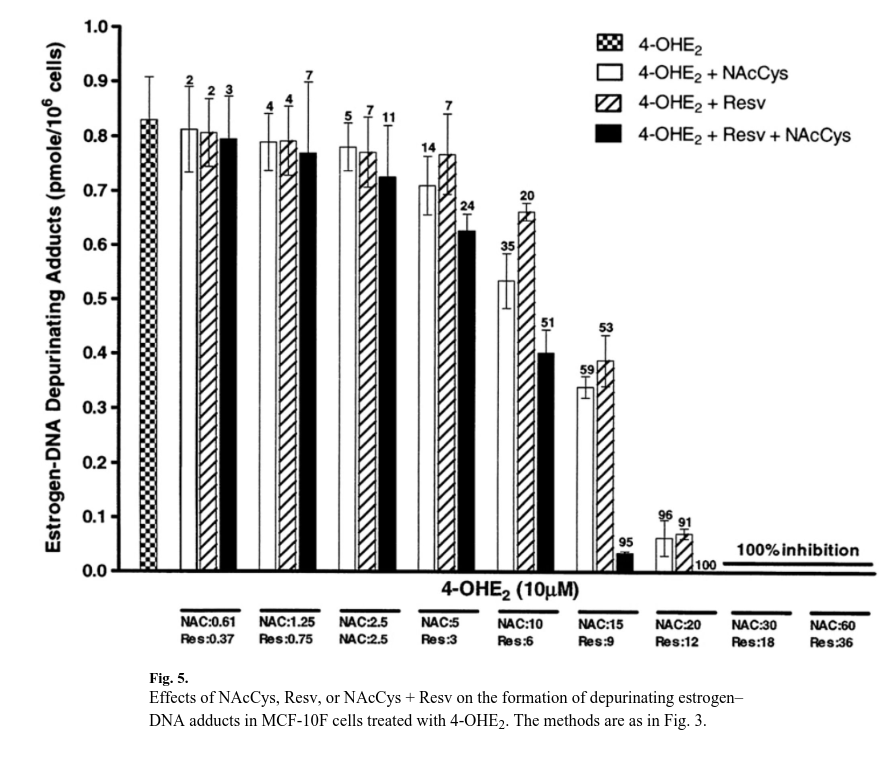
Aductos estrógeno-ADN
Así pues, NAcCys y Resv influyen en el metabolismo de los estrógenos en las células MCF-10F, reduciendo los niveles de quinonas desde los puntos de vista químico (mediante la reducción de las medias quinonas) y biológico (mediante la inducción de enzimas protectoras de fase II).
Las quinonas son esenciales para reaccionar con el ADN y formar aductos estrógeno-ADN.
Se observó una reducción drástica del nivel de aductos purificadores estrógeno-ADN, que se forman predominantemente (en un 99 %) en comparación con los aductos estables (en un 1 %) [28].
A dosis en las que NAcCys es de 15 μM y Resv es de 9 μM, el nivel de aductos se redujo de 0,83±0,14 a 0,34±0,03 (disminución del 59 %) y de 0,39±0,08 pmol/millón de células (disminución del 53 %), respectivamente (fig. 5).
Cuando se mezclaron, estas dosis actuaron de forma aditiva y el nivel de aductos disminuyó a 0,03±0,001 pmol/millón de células (disminución del 95 %).
Las dosis de 20 μM de NAcCys y de 12 μM de Resv redujeron el nivel de aductos en un 96 y 91 %, respectivamente, mientras que la mezcla mostró una inhibición completa.
Las dos dosis más altas mostraron una inhibición del 100 % tanto solas como en la mezcla (fig. 5).
Las pruebas estadísticas mostraron que un modelo de regresión logística de cuatro parámetros se ajustaba significativamente a los datos cuando el término de interacción (ν) se incluía en el modelo (p<0,0001).
El parámetro ν según el modelo de sinergia/antagonismo de Bliss fue de 1,33 (intervalo de confianza del 95 %: 0,87-2,02), que, al ser ligeramente superior a la unidad, mostró que a dosis más altas había indicios de sinergismo, pero el resultado no fue estadísticamente significativo.
Sin embargo, el modelo de Bliss no dependía del parámetro ν y se encontró un mejor ajuste tras su eliminación del modelo, lo que sugiere que la Resv y el NAcCys actúan de forma aditiva sobre los conjugados metoxilo, los conjugados quinona y la formación de aductos de ADN.
En resumen, la inhibición de la formación de aductos estrógeno-ADN fue similar con dosis bajas de NAcCys y Resv, pero con dosis más altas el efecto de Resv fue aproximadamente un 50 % mayor que el de NAcCys.
Se considera que los niveles de aducto depurativo estrógeno-ADN son el punto de partida de las mutaciones que causan el cáncer de mama.
Estos dos antioxidantes (NAcCys y Resv) pueden ser útiles para estudiar la relación entre el metabolismo oxidativo del estrógeno y la aparición del cáncer.
Conclusiones
El metabolismo de los estrógenos se caracteriza por dos procesos principales.
El primero es la 16α-hidroxilación y el segundo es la formación de catecoles por hidroxilación de las posiciones 2 y 4 [1,2].
La 16α-hidroxilación no interviene en ninguna reacción específica con el ADN, mientras que la oxidación de los 2- y 4-catezoles da lugar a las quinonas respectivas, que pueden reaccionar con el ADN.
La reacción más eficaz de estas quinonas con el ADN se produce cuando se forman 3,4-quinonas.
En este caso, una reacción de Michael protonada muy eficaz a 1,4 [46] conduce a la formación predominante (99 %) de aductos purificadores estrógeno-ADN [6,7].
Numerosas pruebas indican que esta reacción con el ADN, que forma principalmente los aductos purificantes N3Ade y N7Gua, es capaz de iniciar la serie de fenómenos que conducen al desarrollo de tumores [21].
Esta reacción con el ADN se produce con mayor eficacia cuando el metabolismo de los estrógenos está desequilibrado, es decir, cuando se forma en exceso quinonas que pueden reaccionar con el ADN.
La reacción de las quinonas catecólicas de los estrógenos con el ADN puede minimizarse mediante los antioxidantes específicos NAcCys y Resv.
La NAcCys ejerce sus efectos protectores de forma química.
De hecho, la NAcCys reacciona directamente con las quinonas de catecol de los estrógenos y se hidroliza para producir cisteína, que se utiliza en la biosíntesis del antioxidante celular GSH (fig. 1).
Además, la NAcCys reduce las semicinonas del estrógeno a catecoles (fig. 1), disminuyendo así la cantidad de quinonas presentes en la célula.
La reducción de semichinonas a catecoles también se consigue mediante la Resv [16,40]. Sin embargo, la Resv también ejerce efectos protectores enzimáticos, es decir, induce la NQO1, que reduce las quinonas a catecoles (fig. 2), y modula la expresión de CYP1B1, que metaboliza específicamente los E2 en 4-OHE2 (fig. 1).
En conclusión, estos dos antioxidantes constituyen una excelente combinación para minimizar el metabolismo de los estrógenos de catecoles a quinonas catecólicas.
Debido a estos efectos, la combinación de NAcCys y Resv es capaz de inhibir el desarrollo de tumores provocados por los estrógenos.
Bibliografia
1. Zhu BT, Conney AH. Functional role of estrogen metabolism in target cells: review and perspectives. Carcinogenesis. 1998; 19:1–27. [PubMed : 9472688]
2. Cavalieri EL, Kumar S, Todorovic R, Higginbotham S, Badawi AF, Rogan EG. Imbalance of estrogen homeostasis in kidney and liver of hamsters treated with estradiol: implications for
estrogen-induced initiation of renal tumors. Chem. Res. Toxicol. 2001; 14:1041–1050. [PubMed : 11511178]
3. Rogan EG, Badawi AF, Devanesan PD, et al. Relative imbalances in estrogen metabolism and conjugation in breast tissue of women with carcinoma: potential biomarkers of susceptibility to
cancer. Carcinogenesis. 2003; 24:697–702. [PubMed : 12727798]
4. Cavalieri EL, Stack DE, Devanesan PD, et al. Molecular origin of cancer: catechol estrogen-3, 4-quinones as endogenous tumor initiators. Proc. Natl. Acad. Sci. USA. 1997; 94:10937–10942.
[PubMed : 9380738]
5. Li K-M, Todorovic R, Devanesan P, et al. Metabolism and DNA binding studies of 4-hydroxyestradiol and estradiol-3, 4-quinone in vitro and in female ACI rat mammary gland in vivo.
Carcinogenesis. 2004; 25:289–297. [PubMed : 14578156]
6. Zahid M, Kohli E, Saeed M, Rogan E, Cavalieri E. The greater reactivity of estradiol-3, 4-quinone versus estradiol-2, 3-quinone with DNA in the formation of depurinating DNA adducts:
implications for tumor-initiating activity. Chem. Res. Toxicol. 2006; 19:164–172. [PubMed : 16411670]
7. Gaikwad NW, Yang L, Muti P, et al. The molecular etiology of breast cancer: evidence from biomarkers of risk. Int. J. Cancer. 2008; 122:1949–1957. [PubMed : 18098283]
8. Yang L, Gaikwad N, Meza J, et al. Novel biomarkers for risk of prostate cancer: results from a case–control study. Prostate. 2009; 69:41–48. [PubMed : 18816637]
9. Chakravarti D, Mailander P, Li K-M, et al. Evidence that a burst of DNA depurination in SENCAR mouse skin induces error-prone repair and forms mutations in the H-ras gene. Oncogene. 2001;
20:7945–7953. [PubMed : 11753677]
10. Mailander PC, Meza JL, Higginbotham S, Chakravarti D. Induction of A.T to G.C mutations by erroneous repair of depurinated DNA following estrogen treatment of the mammary gland of ACI
rats. J. Steroid Biochem. Mol. Biol. 2006; 101:204–215. [PubMed : 16982187]
11. Zhao Z, Kosinska W, Khmelnitsky M, et al. Mutagenic activity of 4-hydroxyestradiol, but not 2-hydroxyestradiol, in BB rat2 embryonic cells, and the mutational spectrum of 4-hydroxyestradiol.
Chem. Res. Toxicol. 2006; 19:475–479. [PubMed : 16544955]
12. Cavalieri E, Chakravarti D, Guttenplan J, et al. Catechol estrogen quinones as initiators of breast and other human cancers : implications for biomarkers of susceptibility and cancer prevention.
BBA Rev. Cancer. 2006; 1766:63–78.
13. Fernandez SV, Russo IH, Russo J. Estradiol and its metabolites 4-hydroxyestradiol and 2-hydroxyestradiol induce mutations in human breast epithelial cells. Int. J. Cancer. 2006;
118:1862–1868. [PubMed : 16287077]
14. Russo J, Fernandez SV, Russo PA, et al. 17-Beta-estradiol induces transformation and tumorigenesis in human breast epithelial cells. FASEB J. 2006; 20:1622–1634. [PubMed :
16873885]
15. Venugopal D, Zahid M, Mailander PC, et al. Reduction of estrogen-induced transformation of mouse mammary epithelial cells by N-acetylcysteine. J. Steroid Biochem. Mol. Biol. 2008;
109:22–30. [PubMed : 18226522]
16. Lu F, Zahid M, Wang C, Saeed M, Cavalieri EL, Rogan EG. Resveratrol prevents estrogen–DNA adduct formation and neoplastic transformation in MCF-10F cells. Cancer Prev. Res. 2008; 1:135–
145.
17. Liehr JG, Fang WF, Sirbasku DA, Ari-Ulubelen A. Carcinogenicity of catecholestrogens in Syrian hamsters. J. Steroid Biochem. 1986; 24:353–356. [PubMed : 3009986]
18. Li JJ, Li SA. Estrogen carcinogenesis in Syrian hamster tissue: role of metabolism. Fed. Proc. 1987; 46:1858–1863. [PubMed : 3030825]
19. Newbold RR, Liehr JG. Induction of uterine adenocarcinoma in CD-1 mice by catechol estrogens. Cancer Res. 2000; 60:235–237. [PubMed : 10667565]
20. Yue W, Santen RJ, Wang JP, et al. Genotoxic metabolites of estradiol in breast : potential mechanism of estradiol induced carcinogenesis. J. Steroid Biochem. Mol. Biol. 2003; 86:477–486.
[PubMed : 14623547]
21. Cavalieri EL, Rogan EG. Depurinating estrogen–DNA adducts in the etiology and prevention of breast and other human cancers. Future Oncol. 2010; 6:75–91. [PubMed : 20021210]
22. Gaikwad NW, Yang L, Pruthi S, et al. Urine biomarkers of risk in the molecular etiology of breast cancer. Breast Cancer : Basic Clin. Res. 2009; 3:1–8.
23. Lu F, Zahid M, Saeed M, Cavalieri EL, Rogan EG. Estrogen metabolism and formation of estrogen–DNA adducts in estradiol-treated MCF-10F cells: the effects of 2, 3, 7, 8-
tetrachlorodibenzo-p-dioxin induction and catechol-O-methyltransferase inhibition. J. Steroid Biochem. Mol. Biol. 2007; 105:150–158. [PubMed : 17582757]
24. Zahid M, Saeed M, Lu F, Gaikwad N, Cavalieri EL, Rogan EG. Inhibition of catechol-O-methyltransferase increases estrogen–DNA adduct formation. Free Radic. Biol. Med. 2007;
43:1534–1540. [PubMed : 17964424]
25. Gaikwad NW, Rogan EG, Cavalieri EL. Evidence from ESI-MS for NQO1-catalyzed reduction of estrogen ortho-quinones. Free Radic. Biol. Med. 2007; 43:1289–1298. [PubMed : 17893042]
26. Montano MM, Chaplin LJ, Deng H, et al. Protective roles of quinone reductase and tamoxifen against estrogen-induced mammary tumorigenesis. Oncogene. 2007; 26:3587–3590. [PubMed :
17160017]
27. Gaikwad NW, Yang L, Rogan EG, Cavalieri EL. Evidence for NQO2-mediated reduction of the carcinogenic estrogen ortho-quinones. Free Radic. Biol. Med. 2009; 46:253–262. [PubMed :
18996184]
28. Zahid M, Gaikwad N, Cavalieri EL, Rogan EG. Inhibition of depurinating estrogen–DNA adduct formation by natural compounds. Chem. Res. Toxicol. 2007; 20:1947–1953. [PubMed : 18039013]
29. Bonanomi L, Gazzaniga A. Toxicological, pharmacokinetic and metabolic studies on acetylcysteine. Eur. J. Respir. Dis. Suppl. 1980; 111:45–51. [PubMed : 6938410]
30. Townsend DM, Tew KD, Tapiero H. The importance of glutathione in human diseases. Biomed. Pharmacother. 2003; 57:145–155. [PubMed : 12818476]
31. Webb WR. New mucolytic agents for sputum liquefaction. Postgrad. Med. 1964; 36:449–453. [PubMed : 14212497]
32. Flanagan RJ. The role of acetylcysteine in clinical toxicology. Med. Toxicol. 1987; 2:93–104. [PubMed : 3574040]
33. Doelman CJ, Bast A. Oxygen radicals in lung pathology. Free Radic. Biol. Med. 1990; 9:381–400. [PubMed : 1705530]
34. De Flora S, Cesarone CF, Balansky RM, et al. Chemopreventive properties and mechanisms of N-acetylcysteine: the experimental background. J. Cell. Biochem. Suppl. 1995; 22:33–41. [PubMed :
8538208]
35. Grandjean EM, Berthet P, Ruffmann R, Leuenberger P. Efficacy of oral long-term N-acetylcysteine in chronic bronchopulmonary disease : a meta-analysis of published double-blind,
placebo-controlled clinical trials. Clin. Ther. 2000; 22:209–221. [PubMed : 10743980]
36. De Flora S, Izzotti A, D’Agostini F, Cesarone CF. Antioxidant activity and other mechanisms of thiols involved in chemoprevention of mutation and cancer. Am. J. Med. 1991; 91:122S–130S.
[PubMed : 1928203]
37. Jang M, Cai L, Udeani GO. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes. Science. 1997; 275:218–220. [PubMed : 8985016]
38. Surh YJ. Cancer chemoprevention with dietary phytochemicals. Nat. Rev. Cancer. 2003; 3:768–780. [PubMed : 14570043]
39. Aziz MH, Kumar R, Ahmad N. Cancer chemoprevention by resveratrol: in vitro and in vivo studies and the underlying mechanisms. Int. J. Oncol. 2003; 23:17–28. [PubMed : 12792772]
40. Zahid M, Gaikwad N, Ali MF, et al. Prevention of estrogen–DNA adducts in MCF-10F cells by resveratrol. Free Radic. Biol. Med. 2008; 45:136–145. [PubMed : 18423413]
41. Zahid M, Saeed M, Ali MF, Rogan EG, Cavalieri EL. N-acetylcysteine blocks formation of cancer-initiating estrogen–DNA adducts in cells. Free Radic. Biol. Med. 2010; 49:392–400. [PubMed :
20472053]
42. Saeed M, Zahid M, Rogan EG, Cavalieri EL. Synthesis of the catechols of natural and synthetic estrogens by using 2-iodoxybenzoic acid (IBX) as the oxidizing agent. Steroids. 2005; 70:173–
178. [PubMed : 15763595]
43. Cao K, Stack DE, Ramanathan R, Gross ML, Rogan EG, Cavalieri EL. Synthesis and structure elucidation of estrogen quinones conjugated with cysteine N-acetylcysteine and glutathione.
Chem. Res. Toxicol. 1998; 11:909–916. [PubMed : 9705753]
44. Denizot F, Lang R. Rapid colorimetric assay for cell growth and survival : modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. J. Immunol. Meth. 1986;
89:271–277.
45. Huynh H, Feldt LS. Estimation of the box correction for degrees of freedom from sample data in the randomized block and split-plot designs. J. Educ. Behav. Stats. 1976; 1:69–82.
46. Bliss CI. The toxicity of poisons applied jointly. Ann. Appl. Biol. 1939; 26:585–615.
47. Samuni AM, Chuang EY, Krishna MC, et al. Semiquinone radical intermediate in catecholic estrogen-mediated cytotoxicity and mutagenesis: chemoprevention strategies with antioxidants.
Proc. Natl. Acad. Sci. USA. 2003; 100:5390–5395. [PubMed : 12702779]